| 세포 내 자가포식(autophagy)을 활성화하는 전사인자 TFEB(transcription factor EB)과 이를 방해하는 전사인자 USF2(upstream transcription factor 2)가 서로 경쟁하며 상호작용하는 메커니즘이 국내 연구진에 의해 처음으로 밝혀졌다.
뇌세포 속 베타 아밀로이드 단백질 증가나 타우 단백질 축적으로 발생하는 알츠하이머, 파킨슨병 등 신경퇴행성 질환을 치료할 수 있는 새로운 길이 열릴지 주목된다.
 서울대학교 생명과학부 백성희 교수 연구팀의 김재범 연구원(박사과정)은 USF2와 TFEB이 자가포식 및 리소좀 유전자 발현에 서로 영향을 주는 경로를 규명했다고 14일 밝혔다.
그간 USF2가 자가포식에 관여할 수 있다는 가능성은 보고된 바 있지만, TFEB과 상호작용을 하고 세포의 영양 상태에 따라 다르게 작동한다는 사실을 확인하기는 처음이다.
자가포식은 세포 항상성을 유지하고 손상되거나 노화된 세포 소기관 등을 스스로 제거하는 우리 인체의 자정작용 중 하나다.
체중 감량과 젊음, 건강한 뇌 유지 등에 큰 영향을 미치는 과정으로 알려지면서 그 작동 원리를 밝히기 위한 다양한 연구가 이뤄지고 있다.
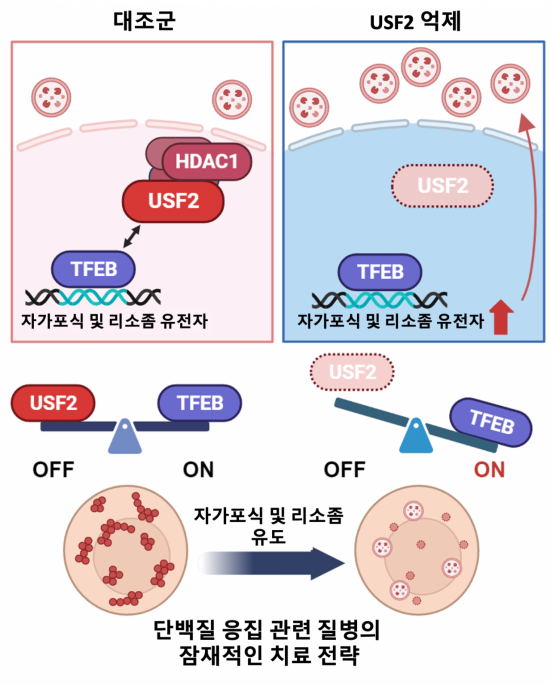
연구팀이 유전자 가위를 이용해 USF2가 결여된 마우스 모델을 만들고 이를 통해 1차 세포주를 제작해 분자생물학적으로 분석한 결과, USF2는 영양이 풍부한 환경에선 NuRD(Nucleus Remodeling Deacetylase) 복합체를 동원해 후성유전학적으로 자가포식 유전자의 발현을 막고 불필요한 자가포식 작용을 억제했다.
반면, 영양 고갈 상태에선 TFEB이 자가포식 경로를 활성화해 세포 생존에 중요한 역할을 했다.
특히, 영양이 부족한 경우 USF2의 탈인산화가 DNA와의 결합력을 감소시켜 TFEB이 더욱 효과적으로 작용하게 하는 것으로 나타났다.
세포가 스트레스를 받는 조건에서 생존하기 위한 중요한 조절 기전인 셈이다.
USF2는 자가포식 및 리소좀 유전자에 결합할 때 TFEB과 동일한 부위에 경쟁적으로 결합하며, 이로 인해 두 전사인자 간에 균형이 이뤄지는 사실도 발견됐다.
이런 경쟁 메커니즘은 세포의 유전자 발현 패턴을 결정하는 중요한 요소로 작용하며, 자가포식 경로의 활성 또는 억제를 조절하게 된다는 게 연구팀의 설명이다.
연구팀은 '알파1-안티트립신 결핍 질병' 모델을 통해 USF2의 억제가 자가포식을 촉진하는 과정도 확인했다.
자가포식이 활성화하면 단백질 응집이 줄어드는 만큼 단백질 응집으로 발생하는 질병의 치료에 활용할 수 있음을 입증한 것이다.
김 연구원은 "USF2를 이용해 리소좀 축적 장애나 신경퇴행성 질환과 같은 단백질 응집성 질환에 새로운 치료 전략을 제시할 수 있는 중요한 발견"이라며 "나아가 유전자 조절 메커니즘에 기반한 맞춤형 치료법 개발에도 기여할 수 있을 것"이라고 내다봤다.
이번 연구 결과는 국제 과학학술지 네이처 커뮤니케이션(Nature Communications)에 지난달 27일 게재됐다.
조인경 기자 [email protected]
<ⓒ투자가를 위한 경제콘텐츠 플랫폼, 아시아경제 무단전재 배포금지> | 